Tendinopatias do Tendão Tibial Posterior A disfunção do tendão tibial posterior (DTTP) é uma condição comum entre as patologias do pé e tornozelo. …
Segundo a Sociedade Brasileira de Dor Orofacial (SBDOF), dor orofacial (DOF) consiste em dor na região face e/ou cavidade oral associada a tecidos moles e mineralizados (pele, vasos sanguíneos, ossos, dentes, glândulas ou músculos)(SBDOF, [s.d.]). Já a Sociedade Internacional de Cefaléia, classifica como dor orofacial como a dor localizada abaixo da linha orbitomeatal, anterior a orelha e acima do pescoço(International Classification of Orofacial Pain, 2020).
O principal sintoma é a de dor, decorrente do envio dos impulsos nervosos por parte destes tecidos através do nervo trigêmio. Esses impulsos são enviados para serem interpretados como dor pelos circuitos cerebrais, e então, são processados e expressos em forma de comportamento (KLASSER et al., 2013).
São mais de 30 tipos de dor orofacial, que se encaixam em 6 grandes grupos, entre os quais estão a dor orofacial atribuída às desordens de estruturas dentoalveolares e anatomicamente relacionadas, dor miofascial orofacial e dor na articulação temporomandibular (ATM) (International Classification of Orofacial Pain, 2020).
A avaliação e o manejo da dor orofacial requerem, na maioria das vezes, a participação de uma equipe multidisciplinar. A razão para tal necessidade é baseada na abrangência diagnóstica de um comprometimento musculoesquelético, neurológico e psicofisiológico (KLASSER et al., 2013).
A dor orofacial, assim como as cefaleias, possuem um consenso para a sua classificação. A Classificação Internacional de Dor Orofacial (ICOP) foi criada com o intuito de aprimorar a pesquisa e o manejo clínico da dor orofacial. O princípio é que as características das desordens guiem a conceituação e o diagnóstico de cada acometimento (International Classification of Orofacial Pain, 2020).
A classificação é hierárquica, e assim como ICHD (The International Classification of Headache Disorders 3rd edition), possui diversas subdivisões em cada um dos 6 principais tópicos. A classificação de nível primário, como citada abaixo, normalmente já é suficiente para a utilização dos profissionais na prática clínica, uma vez que permite identificar o comprometimento do seu paciente. Para pesquisas, devido a necessidade de maior especificidade e detalhamento, é recomendada a utilização das classificações a partir do terceiro nível (International Classification of Orofacial Pain, 2020).
Deixo abaixo as principais definições a serem considerados no diagnóstico de nível primário do ICOP:
Os nocioceptores são responsáveis pelo reconhecimento da propriocepção, estímulos mecânicos, estímulos térmicos e percepção de dor. Quando estimulados, os nocioceptores repassam as informações nociceptivas e transmitem mensagem de dor ao sistema nervoso central (SNC) através das fibras aferentes, do tipo A, B ou C (SESSLE, 2021).
– Fibras do tipo A: são mielinizadas divididas em alfa, beta e gama. As fibras A-delta transmitem estímulos nocivos como a dor associada ao calor. São pequenas, de condução rápida e responsáveis pela dor inicial da nocicepção.
– Fibras do tipo C: metade delas transmitem estímulos nocivos aferentes e são polimodais. A estimulação resulta em períodos iniciais sem dor seguidos de dores difusas e latejantes. Além disso elas se interconectam com o sistema límbico e desempenham um papel na apresentação emocional da dor. No caso da dor crônica de ordem neuropática, a fibra C sensibiliza um segundo neurônio de limiar alto. A estimulação constante e contínua leva à facilitação de estímulos não dolorosos para um estado de hiperalgesia, resultando em uma dor mais intensa.
As informações de dor no SNC são controladas por sistemas inibitórios ascendentes e descendentes que utilizam opioides endógenos ou outras substâncias também endógenas (ex: serotonina), como mediadores inibitórios. Além disso ainda há a inibição das informações relacionadas à dor no nível da medula espinhal. Esses sistemas podem ser ativados de várias maneiras com a estimulação cerebral e estimulação de nervos periféricos, por exemplo (SESSLE, 2021).
A maioria dos impulsos nociceptivos é transmitida pelos nervos somáticos, uma parte significativa é transmitida pelos nervos autonômicos e uma pequena parte pode ser transmitida pelos nervos motores. A inervação sensorial primária das estruturas da face é realizada pelo sistema trigeminal. Esse sistema supervisiona a eficácia e a integridade dos comportamentos orofaciais que são controlados pelos nervos cranianos e modulados pelo sistema nervoso autônomo e sistema límbico. Os nervos cranianos são extensões do cérebro que inervam diretamente ou indiretamente os tecidos envolvidos com o sistema trigeminal (SESSLE, 2021).
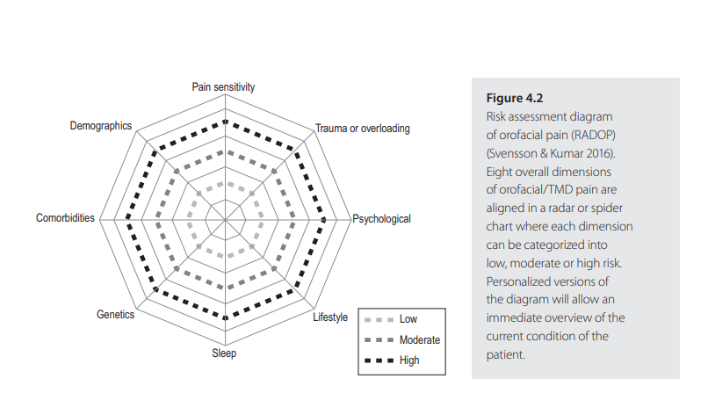
O maior dos nervos cranianos é o nervo trigêmeo, que consiste em três ramos periféricos: (1) o ramo oftálmico, (2) o ramo maxilar e (3) o ramo mandibular (Figura 1).
O nervo trigêmeo é o nervo dominante que transmite impulsos sensoriais da região orofacial para o sistema nervoso central. As regiões onde esses ramos coletam informações sensoriais transmitidas por neurônios de primeira ordem por meio dos gânglios trigeminais abrangem todo o rosto.
O nervo trigêmeo é um nervo misto (sensorial e motor) e inerva principalmente a pele facial, córneas, mucosa oral e nasal, dentes, língua, músculos mastigatórios e revestimentos meníngeos. A entrada sensorial converge no núcleo da via espinhal do tronco cerebral (SESSLE, 2021).
O nervo facial, o nervo glossofaríngeo, os nervos vagos e os nervos cervicais superiores 2 e 3 também transmitem informações sensoriais do rosto e da área circundante.
nervo facial tem um grande componente motor que supre os músculos da expressão facial, platisma e músculos do couro cabeludo, além de um pequeno componente sensorial que fornece o sentido do paladar da língua anterior e a sensação da parótida.
O nervo glossofaríngeo fornece suprimento eferente sensorial às membranas mucosas da faringe, amígdalas palatinas e língua posterior. Enquanto o ramo timpânico fornece informações sensoriais da orelha média, suprimento motor aos músculos da faringe e do palato mole e aferentes viscerais especiais aos botões gustativos da língua posterior. Os cinco nervos cervicais superiores fornecem inervação para a parte de trás da cabeça, face inferior e pescoço. Mais importante, eles convergem no tronco cerebral no núcleo trigeminal (SESSLE, 2021).
Existem alguns fenômenos que podem confundir na hora de fechar o dliagnóstico de dor orofacial. São eles:
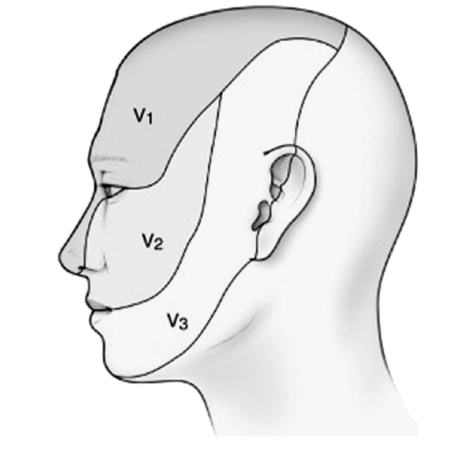
– Dor heterotópica: quando a fonte da dor não está localizada na região da percepção da dor, ou seja, o local onde o paciente sente a dor, que é facilmente localizado perguntando ao paciente para apontar a região do corpo que está dolorida, é o local da dor, no entanto, a fonte da dor, é a área do corpo de onde a dor realmente se origina e pode não necessariamente ser onde o paciente está experimentando a dor.
– Dor referida: É a dor sentida em um local servida por um nervo, mas a fonte de nocicepção chega ao subnúcleo caudal por um nervo diferente. A convergência de múltiplos nervos sensoriais que levam input aos núcleos espinhais trigeminais de tecidos cutâneos e profundos localizados em toda a cabeça e pescoço estabelece o palco para a dor referida. Essa convergência explica como a nocicepção intracraniana, do pescoço, ombro ou garganta pode realmente excitar os neurônios de segunda ordem que recebem input de estruturas faciais (DE ROSSI et al., 2014; SESSLE, 2021).
Pesquisas básicas e clínicas em andamento focadas em condições de dor orofacial aguda e crônica são necessárias para entender as características únicas desse sistema de dor e desenvolver e avaliar formas aprimoradas de tratar pacientes com dor orofacial. Pesquisas adicionais são necessárias para estabelecer esquemas de classificação abrangentes para todos os pacientes com dor orofacial (DE ROSSI et al., 2014).
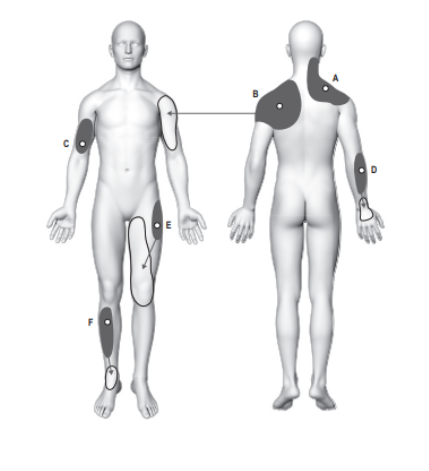
Estudos envolvendo um dos pricipais tipos da dor orofacial crônica, a DTM, já conseguem mapear alterações nas áreas cerebrais decorrente do estímulo doloroso (Figura 3). Foi notado que:
– Existem mudanças estruturais e funcionais no sistema trigêmino-talamocortical, incluindo raízes nervosas trigeminais periféricas, tronco cerebral (subnúcleo caudal do trato espinhal e núcleo sensorial principal do trigêmeo em particular), tálamo e córtex somatossensorial primário (S1), o que fornece suporte para a origem periférica da DTM. Especificamente os resultados de aumento de GMV (volume da matéria cinzenta) no tálamo foram consistentes.
– Existem alterações em várias regiões corticais implicadas na percepção e modulação da dor na DTM. Alterações neuroquímicas são identificadas na ínsula posterior. As FCs (conectividade funcional) alteradas entre a ínsula anterior, córtex cingulado anterior peri-genual (pgACC ) e córtex cingulado médio (MCC) estão correlacionadas com a intensidade da dor. O DMN (Default Mode Network) disfuncional em pacientes com DTM é caracterizado por redução da conectividade funcional no e cortex pré-frontal medial- córtex cingulado posterior (mPFC)/precuneus (mPFC-PCC/PCu) e no córtex pré-frontal- substância cinzanta periarquedutal (PFC-PAG). A interação dor x atenção relacionada a DTM é mediada por redução da FC no córtex cingulado médio anterior- córtex pré frontal dorsolateral (aMCC-dlPFC) e na região pré- genual do córtex cingulado anterior (pgACC- amígdala). Mudanças estruturais na via PAG (peraqueduto cinzento) podem prejudicar a eficiência do sistema endógeno de inibição da dor em pacientes com DTM.
– Mudanças cerebrais funcionais regionais no M1 (córtex motor primário) e SMA (área motora suplementar), bem como aumento de GMV e diminuição da FC no estriado, indicam mudanças compensatórias ou neuroplasticidade mal adaptativa do sistema motor em pacientes com dor na DTM.
– Pacientes com DTM apresentam diferentes ativações cerebrais na rede fronto-insulo-talamo-parietal tanto sob estímulos inócuos quanto dolorosos em comparação com controles (YIN et al., 2020).
Estima-se que a dor orofacial seja um dos mais comuns tipos de dor na população mundial, ocorrendo em cerca de 10 a 15% da população adulta. Em sua forma aguda, a dor orofacial, é majoritariamente representada pelas queixas álgicas relacionadas aos dentes, enquanto a dor crônica aparece nos casos de disfunções musculoesqueléticas e disfunções temporomandibulares (DTM) (HÄGGMAN-HENRIKSON et al., 2020; LIST; JENSEN, 2017).
O índice de cronificação da dor orofacial é cerca de 20% dos casos agudos (SESSLE, 2021). Muitos fatores podem influenciar neste curso, agravando a situação de saúde dos indivíduos portadores com impacto direto na qualidade de vida (Figura 4).
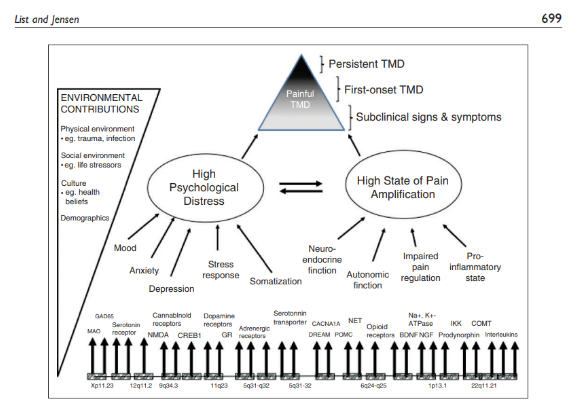
Classificada como uma desordem musculoesquelética a DTM tem característica heterogênea que afeta diferentes estruturas do sistema estomatognático, dentre elas a articulação temporomandibular (ATM), e os músculos da mastigação (LIST & JENSEN, 2017) . Estima-se que, aproximadamente, 10% a 15% da população adulta e 4% a 7% da população jovem mundial apresenta qualquer sinal ou sintoma subjetivo de DTM, e entre 5% e 33% apresentam sinais ou sintomas objetivos (AL-HARTHY et al., 2017; MANFREDINI et al., 2010). A maior ocorrência de DTM acontece em indivíduos entre 20 e 40 anos de idade, especialmente em mulheres (uma em cada três), devido a fatores hormonais, biológicos, psicológicos e psicossociais (DAVIS et al., 2010; FERREIRA, SILVA, FELÍCIO, 2016)
A etiologia da DTM é multifatorial (PECK et al., 2014), porém, não muito clara e os sinais e sintomas resultantes são: condição de dor orofacial (OHRBACH; DWORKIN, 2016), associada ou não a restrição do movimento mandibular (GOMES et al., 2014), diminuição da acuidade auditiva (SCHIFFMAN et al., 2010), parafunções como apertamento dos dentes, ranger dos dentes e roer unhas (MANFREDINI et al., 2009), ruídos articulares, dor muscular, cefaleias associadas, disfunções cervicais, dores craniocervicais, depressão e ansiedade (DOMINICK; BLYTH; NICHOLAS, 2012).
A cronificação dos casos de DTM, é um fator extremamente preocupante para a saúde, uma vez que impacta negativamente na qualidade de vida dos indivíduos portadores (Comissão de Saúde Publica, [s.d.]).
São fatores prognóstico para a cronificação das DTMs a ansiedade, e pertencer ao sexo feminino (HONDA et al., 2018). Bem como, são fatores prognósticos para o surgimento das DTMs, a depressão e a ansiedade, funcionando em uma via de mão dupla (LIOU et al., 2023).
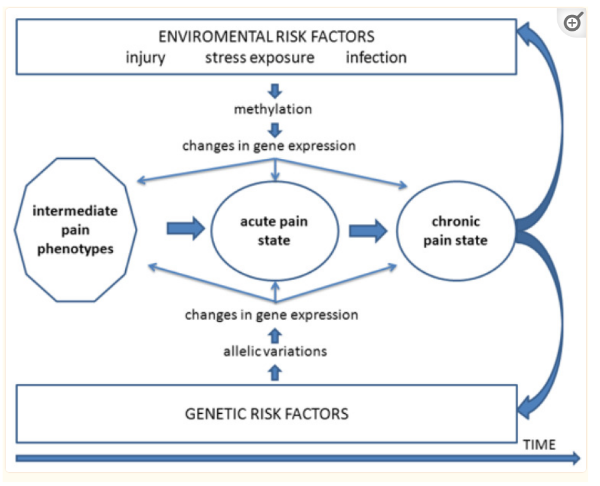
Partindo do conceito de que a DTM é um comprometimento de ordem multifatorial, uma avaliação bem detalhada é importante para programar o tratamento com maior assertividade.
Iniciando pela história do paciente, é importante avaliar a idade do paciente, se ele faz uso de medicação contínua, tabaco, álcool, se há história prévia de trauma na região da face e/ ou presença de outra doença. Esses fatores podem interferir no tempo de consolidação óssea e mascaramento de sinais e sintomas.
A DTM frequentemente apresenta um perfil emocional com baixa incapacidade, alto grau de compromentimento relacionado à dor e níveis elevados a moderados de somatização e depressão (CANALES et al., 2019). O estresse e a depressão, assim como a disfunção cervical coexistem com a DTM, principalmente através da dor miofascial referida. A depressão e a disfunção cervical parecem ser preditores significativos dos níveis percebidos de estresse (SZAREJKO et al., 2023).
O padrão ouro de avaliação para as Disfunções temporomandibulares é o questionário DC/TMD. Este questionário é capaz de identificar a DTM em suas variações e algumas afecções associadas.
O DC/TMD é capaz de diagnosticar quadros de mialgia, mialgia local, dor miofascial, dor miofascial com espalhamento, dor miofascial referida, artralgia e cefaléia atribuída a DTM e o diagnóstico clínico que refere aos comprometimentos articulares.
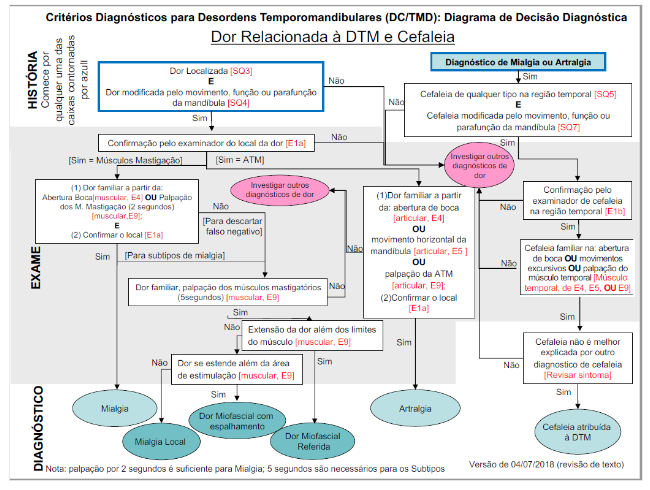
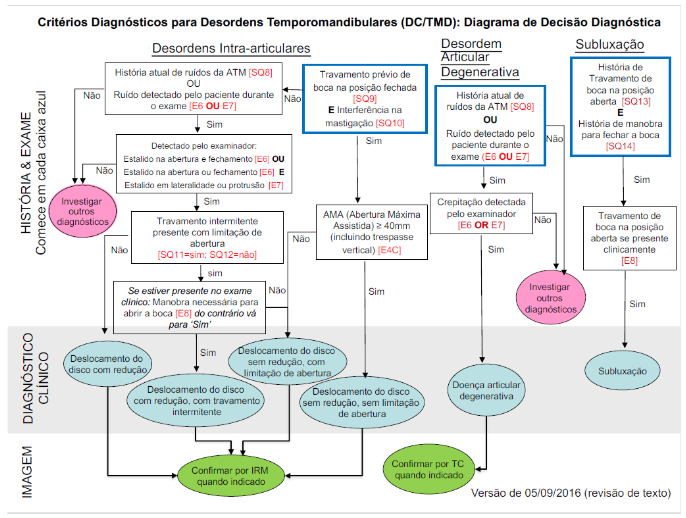
Estes diagnósticos podem ser considerados “essenciais” na avaliação de pacientes com queixas de dor orofacial, visto a alta prevalência das DTMs dentro das dores orofaciais.
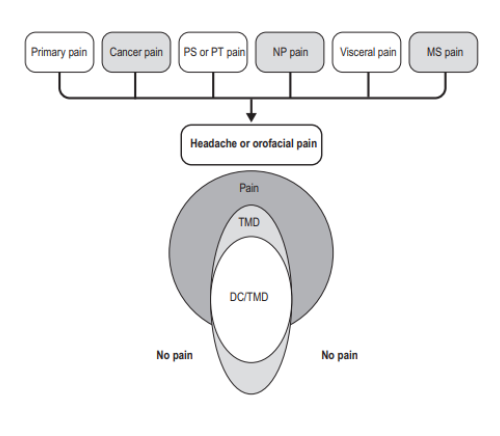
Os principais diagnósticos apresentam características específicas como por exemplo:
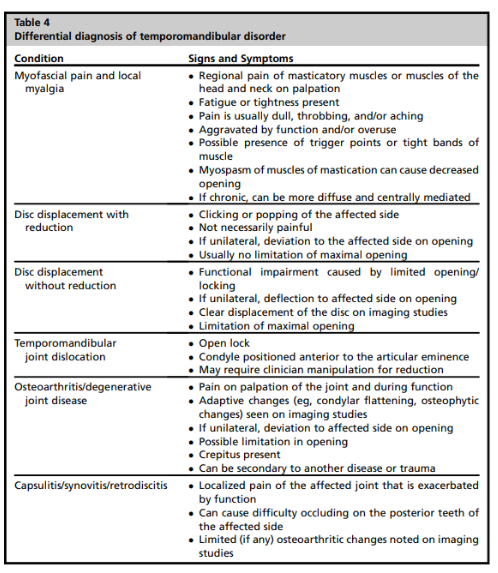
Devido ao aspecto multifatorial das Disfunções Temporomandibulares, além do DC/TMD são sugeridos outras avaliações complementares. Estas avaliações são feitas, majoritariamente, através da aplicação de questionários. São eles:
Depressão: PHQ-9
– Sugerida pelo DC-TMD como ferramenta complementar de avaliação
– Se faz importante incluir a avaliação de depressão, devido ao seu potencial de transformar comprometimentos agudos em crônicos.
– Mede o risco e severidade da depressão
– São 9 questões:
• Pontuação máxima: 27
• 5-9: depressão leve
• 10-14: depressão moderada
• 15-19: depressão moderadamente grave
• ≥ 20: depressão grave
Ansiedade: GAD-7
– Sugerida pelo DC-TMD como ferramenta complementar de avaliação
– Sua inclusão na avaliação se faz importante, devido ao seu potencial de transformar comprometimentos agudos em crônicos.
– Tria de mede o grau de ansiedade.
– Quanto maior a pontuação pior, maior a chance desse paciente sofrer de ansiedade.
Catastrofização: PCS
– Escala de catastrofização da dor
– Busca avaliar o grau de catastrofização sobre a dor. É um questionário autoaplicável composto de 13 itens, no qual o paciente deve relatar o grau com que apresenta qualquer pensamento ou sentimento descrito no questionário, sempre respeitando uma graduação de 5 pontos. O instrumento é composto por 3 subescarlas:
• Desesperança
• Magnificação
• Ruminação
– Os itens são classificados em uma escala de 5 pontos, em que tanto a intensidade quanto a frequência de informações são avaliadas. A pontuação para subescalas são dadas pela soma dos itens correspondentes, e a pontuação total é calculada pela soma de todos os itens. A pontuação varia de 0 a 52 pontos (SULLIVAN; BISHOP; PIVIK, 1995)
Cinesiofobia: TAMPA- DTM
– Define- se cinesiofobia como: “Medo excessivo, irracional e debilitante do movimento e da atividade física que resulta em sentimentos de vulnerabilidade à dor ou a reincidência da lesão”.
– Se faz importante avaliar a cinesiofobia, pois evidências mostram que a sua presença é capaz de perpetuar a dor e a disfunção (DUPUIS et al., 2023)
– A escala consiste em um questionário auto-aplicável composto por 18 questões que abordam a dor e a intensidade dos sintomas da DTM e por 2 domínios compostos por questões relacionadas a dor e intensidade dos sintomas:
• Evitando movimento: Crença de que o movimento pode resultar em lesão ou dor (questões 1, 2, 10, 13, 15, 17 e 18)
• Foco somático: Crença de que há problemas de saúde graves subjacentes (3, 5, 6, 7 e 11)
– A escala relaciona o medo que a atividade física ou os movimentos mandibulares possam causar dor e/ou reincidência de lesão, com a cronicidade da DTM. Os escores variam de um a quatro pontos. Para a obtenção do escore total final é necessário a inversão dos escores das questões quatro, oito, doze e dezesseis, o escore final pode ser de no mínimo 18 e no máximo 72 pontos, sendo que quanto maior a pontuação, maior o grau de cinesiofobia (VISSCHER et al., 2010).
– Quanto maior a pontuação, maior a chance desse paciente ter cinesiofobia.
Sensibiliazação Central: CSI
– É um questionário composto por duas partes:
A: Contém 25 afirmações, que podem ser pontuadas em uma escala do tipo Likert temporal de 5 pontos (0 a 4). Quanto maior o valor, maior o grau de sensibilização central, podendo variar de 0 a 100 pontos no total. Essa parte avalia os sintomas de saúde atuais
B: Avalia se o paciente já foi previamente diagnosticado com alguma das doenças incluídas na síndrome da sensibilidade central e o ano de diagnóstico (MAYER et al., 2012).
Dor orofacial: CF-PDI
– É uma escala auto-aplicável que mensura resultados relacionados a dor e função relacionado a dor craniofacial.
– Consiste em 21 itens, com um score total que pode variar de 0 a 63 pontos. Cada questão é pontuada de 0-3 pontos, sendo que quanto maior a pontuação, maior a disfunção (GREGHI et al., 2018).
Disfunção Temporomandibular: DC/TMD
– É o padrão ouro para a avaliação temporomandibular. O DC/TMD é bastante completo. Ele fornecerá o diagnóstico do paciente como mialgia, mialgia local, dor miofascial, dor miofascial com espalhamento, dor miofascial com dor referida, artralgia e cefaleia atribuída à DTM, chegando até a recomendar a realização de exames complementares. Para chegar ao diagnóstico é necessário que dois “eixos principais” do questionário sejam preenchidos:
• Eixo dos sintomas: Contém perguntas relacionadas às queixas do paciente.
• Eixo II: Composto por questões relacionadas à avaliação por parte do profissional da saúde como dor à palpação específica de alguns pontos musculares, padrão de abertura e presença de ruídos articulares, por exemplo.
Além disso outras variáveis devem ser analisadas como:
Parafunção ou hábitos parafuncionais:
• É um hábito parafuncional morder os lábios, chupar o dedo, onicofagia e também, entre os mais comuns, o bruxismo. O bruxismo é definido como: “Transtorno involuntário e inconsciente de movimento, caracterizado pelo excessivo apertamento e/ou ranger os dentes, podendo ocorrer durante o sono ou em vigília- o ranger envolve um forte contato entre os dentes superiores e inferiores, seguido de movimentos da mandíbula, produzindo sons desagradáveis, enquanto o apertamento se caracteriza por contatos dentários silenciosos, fortes e sem movimentos mandibulares ” (“Livro – Bruxismo – Maciel”, [s.d.])
No que se acredita, atualmente é que o movimento ou excitação muscular sem controle, gerada por qualquer um destes hábitos é capaz de gerar espasmo e tensão muscular.
Fatores modificáveis como estresse, ansiedade, deficiências nutricionais e uso de alguns medicamentos, estão diretamente ligados a melhora ou piora na intensidade do bruxismo (FROSZTEGA et al., 2023; “Livro – Bruxismo – Maciel”, [s.d.]).
Podem aparecer em forma de sinais e sintomas dos hábitos parafuncionais alguns transtornos otológicos, hipertrofia muscular, fratura, hipersensibilidade e desgaste nos dentes (LOBBEZOO et al., 2018).
A avaliação dos hábitos parafuncionais pode ser feita perguntando ao próprio paciente se ele possui algum dos hábitos e observando marcas nas bochechas, língua, cuspides dentárias e simetria facial (“Livro – Bruxismo – Maciel”, [s.d.]; LOBBEZOO et al., 2018).
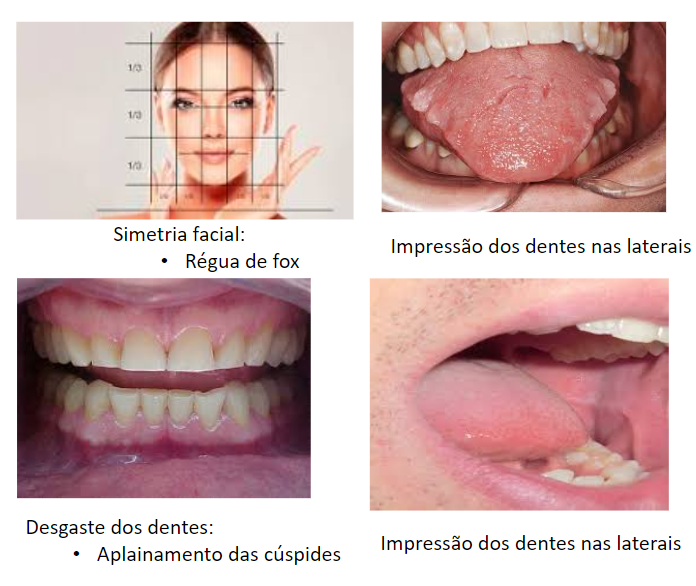
Postura:
Apesar de muito ser pesquisado e diversas teorias tentarem explicar, não é possível estabelecer relação entre a postura e a DTM. Estudos sugerem que hábitos posturais e parafunção podem contribuir para o surgimento dos sintomas da DTM quando combinados a outros hábitos (ABE et al., 2022).
Um estudo recente observou que não há relação direta entre pontos gatilhos da musculatura cervical e dos músculos mastigatórios com a DTM. Os pontos gatilhos dos músculos mastigatórios e da musculatura cervical apresentam relação forte a moderada relação entre si. Faz-se valer então que a relação existente entre a dor cervical em pacientes com DTM tem relação com pontos gatilhos e não com a postura (YAO et al., 2023).
Outros artigos ainda identificam fraqueza e hipermobilidade da musculatura profunda da região cervical alta, mas não relacionam a alterações posturais (FERREIRA et al., 2019; T et al., 2020).
A avaliação postural pode ser feita de diversos modos, desde registros fotográficos do indivíduo em ortostatismo de perfil, anterior e posterior até através de exames de imagens que falam, por exemplo, sobre o ângulo crâniocervical.
Sono:
Sono é definido como: “Estado fisiológico, com perda temporária da consciência e mudanças de várias funções, base biológica de repouso do SNC, de músculos, órgãos e medula. Dormir não é apenas uma necessidade de descanso mental e físico, pois durante o sono ocorrem importantes processos biológicos (“Livro – Bruxismo – Maciel”, [s.d.]).
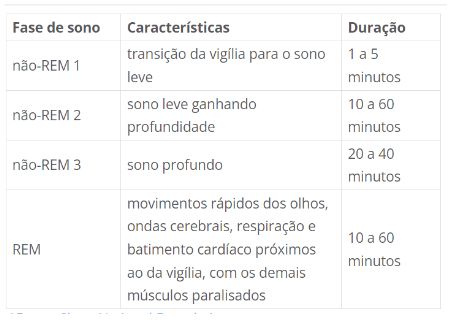
O sono é composto de 5 a 6 ciclos com cerca de 90 minutos cada. Cada ciclo é composto por 2 fases principais, a do sono REM (rapid eye movement) e Não REM (not rapid movement eye). Quando um indivíduo tem alterações do sono, algumas manifestações começam a aparecer como a cronificação de quadros agudos de dor e aumento da intensidade da dor (“Instituto do Sono – Fases de sono”, [s.d.]).
O melhor tipo de avaliação para o sono é a polissonografia, uma vez que ela fará o monitoramento de uma noite completa de sono. No mais, caso sejamos profissionais de primeiro contato, para entender se é interessante que esse paciente tome maiores cuidados com o sono, podemos fazer perguntas como: “ como você dorme? Acorda a noite? Acorda descansado? Ronca? Aperta os dentes ou acorda com os dentes doloridos? Após essas perguntas rápidas, será possível entender se o paciente tem ou não um sono alterado e entender se há a necessidade de maior ajuda.”
Oclusão
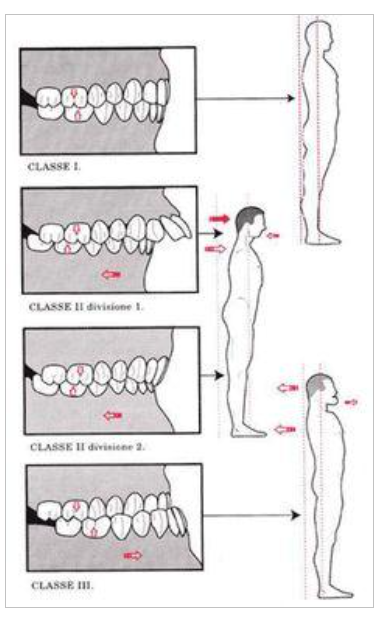
Apesar de muitas linhas defenderem, ainda não há evidência suficiente para afirmar que a oclusão apresenta relação com equilíbrio (CABRERA-DOMÍNGUEZ et al., 2021), com o “click” articular (relacionado normalmente ao deslocamento de disco com redução)(MANFREDINI; PERINETTI; GUARDA-NARDINI, 2014) e até mesmo os sinais e sintomas de DTM (EBADIAN; ABBASI; NAZARIFAR, 2020). A oclusão pode ser classificada pela ANGLE
DOR:
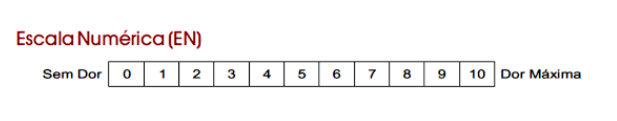
A dor é uma das principais queixas dos pacientes com DTM, sendo na maioria das vezes o parâmetro para controle da progressão do tratamento, combinada a funcionalidade. O mais recomendado para a avaliação da dor é a Escala numérica de dor (END). A END pode ser usada pré e pós tratamento e deve sempre referir ao relato do paciente com a média de dor nas últimas 24h. A mínima mudança importante é 10-15% (1 unidade) (DWORKIN et al., 2005)
Função mandibular:
Um dos questionários mais utilizados é o Mandibular Function Impairment Questionnaire (MFIQ). Esse questionário é usado para quantificar a severidade da limitação da funcionalidade mandibular relacionada à DTM.
Originalmente ele é composto por 17 questões, pontuadas de 0 a 4, sendo que quanto maior a pontuação, maior a limitação funcional dos sujeitos. A versão da escala validada para o português mostrou boa confiabilidade quando os itens 1, 2, 6 e 7 não foram considerados na pontuação final (CAMPOS et al., 2014). Sendo assim, a pontuação máxima do MFIQ nesse estudo foi de 52 ao invés de 68.
A diferença mínima detectável determinada por um estudo prévio para essa variável foi de 8 unidades, considerando uma na escala de 0 a 68 pontos (KROPMANS et al., 1999).
Hábitos de vida:
Como supracitado, os maus hábitos podem gerar grandes interferências no curso e nas características da DTM. Monitorar os hábitos e buscar melhorá-los é extremamente importante. Durante a avaliação é importante fazer o registro sobre os hábitos de vida do indivíduo desde a alimentação, prática de atividade física, qualidade do sono, horas trabalhadas.
Pode ser pedido ao paciente fazer o registro diário por uma semana e levar a próxima consulta, para que possa ser auxiliado a adaptações para auxílio na melhora do caso.
Alguns dos questionários citados podem ser encontrados aqui.
A evidência para o tratamento adequado ainda é fraca. No entanto, já conseguimos perceber que a combinação de técnicas de tratamento apresenta resultados superiores com relação a aplicação de técnicas isoladas.
Entre as terapias empregadas para o tratamento das DTMs temos a psicoterapia, terapia cognitivo comportamental, medicamentosa e a fisioterapia através de sua grande disponibilidade de técnicas. Algumas abordagens que ganham destaque são:
– Terapia manual: Há evidências de qualidade moderada a alta dos efeitos positivos da terapia manual na intensidade da dor, abertura de boca e funcionalidade relacionados a indivíduos portadores de DTM, no entanto o tamanho do efeito dos estudos são pequenos e podem não ser clinicamente significantes (VIEIRA et al., 2023). O resultado pode ser percebido a médio prazo e tende a reduzir gradativamente se não complementado com exercícios terapêuticos (HERRERA-VALENCIA et al., 2020).
– Dry needling: Gera efeito satisfatório para o tratamento de dor miofascial relacionada a DTM (NOWAK et al., 2021), reduzindo a dor e a atividade muscular dos músculos agulhados (DIB-ZAKKOUR et al., 2022), aumentando o limiar de dor induzido por pressão e amplitude de abertura de boca (FERNÁNDEZ-CARNERO et al., 2010). No entanto, é importante manter a atenção a qualidade dos artigos, pois a evidência ainda é de baixa qualidade (AL-MORAISSI et al., 2020).
– Placas oclusais: Auxiliam no alívio da dor a curto prazo, mas iguala a outras terapias a longo prazo (KELEMEN et al., 2023; KUZMANOVIC PFICER et al., 2017). Apresenta pequeno efeito na melhora da dor, mas não para a melhora da abertura (0-3 meses sem diferença). Quando comparadas, apresentam ser superiores a intervenção mínima (educação e exercícios domiciliares) e a placa inespecífica para melhora da dor (RILEY et al., 2020).
Combinação de técnicas:
• Laser de baixa intensidade e a liberação miofascial somada a exercícios terapêuticos são capazes de melhorar a dor e as variáveis funcionais, como a abertura da boca, em pacientes com DTM. O tamanho do efeito é grande para a melhora da dor e da amplitude de movimento de abertura da boca, e moderado para a combinação entre terapia manual e exercícios terapêuticos. A qualidade da evidência é limitada para a aplicação do laser relacionada a amplitude de movimento de abertura da boca e para terapia manual combinada a exercícios terapêuticos na dor (ARRIBAS-PASCUAL et al., 2023).
• Laser infravermelho combinado a exercícios para língua, lábios, bochechas e músculos mastigatórios visando mobilidade, endurance e força muscular, associado a treino da função mandibular, educação sobre os distúrbios miofuncionais, sobre a necessidade controle da sobrecarga nas região e estratégias para alívio da dor (como calor, massagem e treino de relaxamento) apresentam ser o melhor tratamento para casos de DTM crônica, em comparação a qualquer outra combinação possível dentro dessas possibilidades de tratamento (MACHADO et al., 2016).
• A combinação de terapia manual e placas oclusais ou eletroterapia influenciam positivamente na percepção dos sintomas reduzindo a dor, disfunção, algumas questões relacionadas a oclusão e na percepção da mudança (BRIGHENTI et al., 2023)
– Botox: Ainda não há evidência suficiente para dizer que o Botox tem efeito nas queixas relacionadas às DTM (DELCANHO et al., 2022; THAMBAR et al., 2020). Os resultados são promissores, mas a qualidade dos artigos não permite concluir nada a respeito. Estudos sugerem que parece apropriado que as opções de tratamento conservador como autocuidado, orientações e fisioterapia, sejam exploradas primeiro (PATEL; CARDOSO; MEHTA, 2019).
– Abordagens cervicais: Parece não haver efeito clinicamente significativo para a mobilização/ manipulação de cervical alta com relação aos sintomas da DTM. É preciso ser cauteloso ao afirmar sobre tal conclusão pois ainda há grande heterogeneidade nos artigos e imprecisão no efeito dos tratamentos (LAM; LIDDLE; MACLELLAN, 2023).
– Acupuntura: É efetiva em reduzir níveis de dor em pacientes com DTM, especialmente nos que possuem sintomas miofasciais (WU et al., 2017).
– Terapia cognitivo comportamental: Quando comparada a liberação intra-oral, muitas vezes pode apresentar resultados inferiores (KALAMIR et al., 2013). Mas estudos observam que ela é capaz de potencializar o efeito do tratamento da terapia manual combinada a exercícios aplicados em indivíduos portadores de DTM crônica (“Education-Enhanced Conventional Care versus Conventional Care Alone for Temporomandibular Disorders”, 2023).
Para dar alta ao paciente podemos reaplicar as escalas do início do tratamento, verificando se houve melhora satisfatória. Para alguns questionários existe a mínima diferença clinicamente significante (MCID) calculada, que faz referência a melhora mínima na pontuação do questionário para dizermos que realmente o tratamento foi efetivo. Essa medida é construída a partir da opinião dos pacientes, que julgam a quantidade de melhora capaz de trazer benefícios para a melhora do quadro de queixa principal. Na END, por exemplo, a intensidade da dor em pacientes com DTM é de 1,2cm na dor máxima, 1,9 cm na dor atual e 0,9 cm na escala de dor mínima (OOI et al., 2022).
É importante que seja reavaliada a queixa principal do paciente, se houve melhora, o grau de melhora e como o paciente se sente com relação a ela agora. As avaliações utilizadas anteriormente como ADM, pontos dolorosos à palpação e função, por exemplo, podem ser incluídos como critérios.
ABE, S. et al. Relationship between Oral Parafunctional and Postural Habits and the Symptoms of Temporomandibular Disorders: A Survey-Based Cross-Sectional Cohort Study Using Propensity Score Matching Analysis. Journal of Clinical Medicine, v. 11, n. 21, p. 6396, 28 out. 2022.
AL-HARTHY, M. et al. Influence of culture on pain comorbidity in women with and without temporomandibular disorder-pain. Journal of Oral Rehabilitation, v. 44, n. 6, p. 415–425, jun. 2017.
AL-MORAISSI, E. A. et al. Needling therapies in the management of myofascial pain of the masticatory muscles: A network meta-analysis of randomised clinical trials. Journal of Oral Rehabilitation, v. 47, n. 7, p. 910–922, jul. 2020.
ARRIBAS-PASCUAL, M. et al. Effects of Physiotherapy on Pain and Mouth Opening in Temporomandibular Disorders: An Umbrella and Mapping Systematic Review with Meta-Meta-Analysis. Journal of Clinical Medicine, v. 12, n. 3, p. 788, 18 jan. 2023.
BRIGHENTI, N. et al. Effects of an Interdisciplinary Approach in the Management of Temporomandibular Disorders: A Scoping Review. International Journal of Environmental Research and Public Health, v. 20, n. 4, p. 2777, 4 fev. 2023.
CABRERA-DOMÍNGUEZ, M. E. et al. Dental Malocclusion and Its Relation to the Podal System. Frontiers in Pediatrics, v. 9, 2021.
CAMPOS, J. A. D. B. et al. Epidemiology of severity of temporomandibular disorders in Brazilian women. Journal of oral & facial pain and headache, v. 28, n. 2, p. 147–152, Spring 2014.
CANALES, G. D. L. T. et al. Distribution of depression, somatization and pain-related impairment in patients with chronic temporomandibular disorders. Journal of applied oral science: revista FOB, v. 27, p. e20180210, 7 jan. 2019.
Comissão de Saúde Publica. Disponível em: <https://sbdof.com.br/comissao-de-saude-publica-1.html>. Acesso em: 27 jun. 2023.
DAVIS, C. E. et al. Use of a structural equation model for prediction of pain symptoms in patients with orofacial pain and temporomandibular disorders. Journal of orofacial pain, v. 24, n. 1, p. 89–100, Winter 2010.
DE ROSSI, S. S. et al. Temporomandibular disorders: evaluation and management. The Medical clinics of North America, v. 98, n. 6, p. 1353–1384, nov. 2014.
DELCANHO, R. et al. Botulinum Toxin for Treating Temporomandibular Disorders: What is the Evidence? Journal of Oral & Facial Pain and Headache, v. 36, n. 1, p. 6–20, 2022.
DIB-ZAKKOUR, J. et al. Evaluation of the Effectiveness of Dry Needling in the Treatment of Myogenous Temporomandibular Joint Disorders. Medicina, v. 58, n. 2, fev. 2022.
DOMINICK, C. H.; BLYTH, F. M.; NICHOLAS, M. K. Unpacking the burden: understanding the relationships between chronic pain and comorbidity in the general population. Pain, v. 153, n. 2, p. 293–304, fev. 2012.
SBDOF. DTM e Dor Orofacial. Disponível em: <https://www.sbdof.com.br/dtm-e-dor-orofacial.html>. Acesso em: 27 jun. 2023.
DUPUIS, F. et al. The Tampa Scale of Kinesiophobia: A Systematic Review of Its Psychometric Properties in People With Musculoskeletal Pain. The Clinical Journal of Pain, v. 39, n. 5, p. 236, maio 2023.
DWORKIN, R. H. et al. Core outcome measures for chronic pain clinical trials: IMMPACT recommendations. Pain, v. 113, n. 1–2, p. 9–19, jan. 2005.
EBADIAN, B.; ABBASI, M.; NAZARIFAR, A. M. Frequency distribution of temporomandibular disorders according to occlusal factors: A cross-sectional study. Dental Research Journal, v. 17, n. 3, p. 186, jun. 2020.
Education-Enhanced Conventional Care versus Conventional Care Alone for Temporomandibular Disorders: A Randomized Controlled Trial. The Journal of Pain, v. 24, n. 2, p. 251–263, 1 fev. 2023.
FERNÁNDEZ-CARNERO, J. et al. Short-term effects of dry needling of active myofascial trigger points in the masseter muscle in patients with temporomandibular disorders. Journal of orofacial pain, v. 24, n. 1, p. 106–112, Winter 2010.
FERREIRA, C. L. P.; SILVA, M. A. M. R. DA; FELÍCIO, C. M. DE. Signs and symptoms of temporomandibular disorders in women and men. CoDAS, v. 28, n. 1, p. 17–21, fev. 2016.
FERREIRA, M. P. et al. Mobility of the upper cervical spine and muscle performance of the deep flexors in women with temporomandibular disorders. Journal of Oral Rehabilitation, v. 46, n. 12, p. 1177–1184, dez. 2019.
FROSZTEGA, W. et al. The effect of coffee and black tea consumption on sleep bruxism intensity based on polysomnographic examination. Heliyon, v. 9, n. 5, p. e16212, maio 2023.
GOMES, C. A. F. DE P. et al. Correlation between severity of temporomandibular disorder and mandibular range of motion. Journal of Bodywork and Movement Therapies, v. 18, n. 2, p. 306–310, abr. 2014.
GREGHI, S. M. et al. Brazilian Portuguese Version of the Craniofacial Pain and Disability Inventory: Cross-Cultural Reliability, Internal Consistency, and Construct and Structural Validity. Journal of Oral & Facial Pain and Headache, v. 32, n. 4, p. 389–399, Fall 2018.
HÄGGMAN-HENRIKSON, B. et al. Increasing gender differences in the prevalence and chronification of orofacial pain in the population. Pain, v. 161, n. 8, p. 1768–1775, ago. 2020.
HERRERA-VALENCIA, A. et al. Effcacy of Manual Therapy in TemporomandibularJoint Disorders and Its Medium-and Long-TermEffects on Pain and Maximum Mouth Opening:A Systematic Review and Meta-Analysis. Journal of clinical medicine, v. 9, n. 11, 23 out. 2020.
HONDA, Y. et al. Comparison of Risk Factors in Patients With Acute and Chronic Orofacial Pain. Anesthesia Progress, v. 65, n. 3, p. 162, Fall 2018.
Instituto do Sono – Fases de sono: veja quais são e entenda a importância. Disponível em: <https://institutodosono.com/artigos-noticias/fases-de-sono-veja-quais-sao-e-entenda-a-importancia/>. Acesso em: 6 jul. 2023.
International Classification of Orofacial Pain, 1st edition (ICOP). Cephalalgia, v. 40, n. 2, p. 129–221, 1 fev. 2020.
KALAMIR, A. et al. Intra-oral myofascial therapy versus education and self-care in the treatment of chronic, myogenous temporomandibular disorder: a randomised, clinical trial. Chiropractic & Manual Therapies, v. 21, p. 17, 2013.
KELEMEN, K. et al. Additional splint therapy has no superiority in myogenic temporomandibular disorders: A systematic review and meta-analysis of randomized controlled trials. Journal of Prosthodontic Research, 8 jun. 2023.
KLASSER, G. D.; LEEUW, R. DE; AMERICAN ACADEMY OF OROFACIAL PAIN. Orofacial pain: guidelines for assessment, diagnosis, and management. Em: 5th edition. ed. Chicago: Quintessence Publishing Co, Inc, 2013.
KROPMANS, T. J. et al. The smallest detectable difference of mandibular function impairment in patients with a painfully restricted temporomandibular joint. Journal of Dental Research, v. 78, n. 8, p. 1445–1449, ago. 1999.
KUZMANOVIC PFICER, J. et al. Occlusal stabilization splint for patients with temporomandibular disorders: Meta-analysis of short and long term effects. PloS one, v. 12, n. 2, p. e0171296, 2017.
LAM, A. C.; LIDDLE, L. J.; MACLELLAN, C. L. The Effect of Upper Cervical Mobilization/Manipulation on Temporomandibular Joint Pain, Maximal Mouth Opening, and Pressure Pain Thresholds: A Systematic Review and Meta-Analysis. Archives of Rehabilitation Research and Clinical Translation, v. 5, n. 1, mar. 2023.
LIOU, Y.-J. et al. Bidirectional Associations of Temporomandibular Joint Disorders with Major Depressive and Anxiety Disorders. Journal of Evidence-Based Dental Practice, v. 23, n. 2, p. 101860, 1 jun. 2023.
LIST, T.; JENSEN, R. H. Temporomandibular disorders: Old ideas and new concepts. Cephalalgia, v. 37, n. 7, p. 692–704, 1 jun. 2017.
Livro – Bruxismo – Maciel. Disponível em: <https://www.livrariaflorence.com.br/produto/livro-bruxismo-maciel-137169?gclid=CjwKCAjw44mlBhAQEiwAqP3eVvpPnHJHeQ-sSUNv989RtJsa5_LlRMBIG_BR3WO49zJZorTW-PEMbRoCImwQAvD_BwE>. Acesso em: 3 jul. 2023.
LOBBEZOO, F. et al. International consensus on the assessment of bruxism: Report of a work in progress. Journal of Oral Rehabilitation, v. 45, n. 11, p. 837–844, nov. 2018.
MACHADO, B. C. Z. et al. Effects of oral motor exercises and laser therapy on chronic temporomandibular disorders: a randomized study with follow-up. Lasers in medical science, v. 31, n. 5, p. 945–954, jul. 2016.
MANFREDINI, D. et al. Psychosocial profiles of painful TMD patients. Journal of Oral Rehabilitation, v. 36, n. 3, p. 193–198, mar. 2009.
MANFREDINI, D. et al. Chronic pain severity and depression/somatization levels in TMD patients. The International Journal of Prosthodontics, v. 23, n. 6, p. 529–534, dez. 2010.
MANFREDINI, D.; PERINETTI, G.; GUARDA-NARDINI, L. Dental malocclusion is not related to temporomandibular joint clicking: a logistic regression analysis in a patient population. The Angle orthodontist, v. 84, n. 2, p. 310–315, mar. 2014.
MAYER, T. G. et al. The Development and Psychometric Validation of the Central Sensitization Inventory (CSI). Pain Practice, v. 12, n. 4, p. 276–285, abr. 2012.
NOWAK, Z. et al. Intramuscular Injections and Dry Needling within Masticatory Muscles in Management of Myofascial Pain. Systematic Review of Clinical Trials. International Journal of Environmental Research and Public Health, v. 18, n. 18, set. 2021.
OHRBACH, R.; DWORKIN, S. F. The Evolution of TMD Diagnosis: Past, Present, Future. Journal of Dental Research, v. 95, n. 10, p. 1093–1101, set. 2016.
OOI, K. et al. Therapy outcome measures in temporomandibular disorder: a scoping review. BMJ Open, v. 12, n. 8, p. e061387, 19 ago. 2022.
PATEL, J.; CARDOSO, J. A.; MEHTA, S. A systematic review of botulinum toxin in the management of patients with temporomandibular disorders and bruxism. British Dental Journal, v. 226, n. 9, p. 667–672, maio 2019.
PECK, C. C. et al. Expanding the Taxonomy of the Diagnostic Criteria for Temporomandibular Disorders (DC/TMD). Journal of oral rehabilitation, v. 41, n. 1, p. 2–23, jan. 2014.
RILEY, P. et al. Oral splints for patients with temporomandibular disorders or bruxism: a systematic review and economic evaluation. Health technology assessment (Winchester, England), v. 24, n. 7, p. 1–224, fev. 2020.
SCHIFFMAN, E. L. et al. Assessment of the Validity of the Research Diagnostic Criteria for Temporomandibular Disorders: Overview and Methodology. Journal of orofacial pain, v. 24, n. 1, p. 7–24, 2010.
SESSLE, B. J. Chronic Orofacial Pain: Models, Mechanisms, and Genetic and Related Environmental Influences. International Journal of Molecular Sciences, v. 22, n. 13, jul. 2021.
SULLIVAN, M. J. L.; BISHOP, S. R.; PIVIK, J. The Pain Catastrophizing Scale: Development and validation. Psychological Assessment, v. 7, n. 4, p. 524–532, 1995.
SZAREJKO, K. D. et al. Stress Experience, Depression and Neck Disability in Patients with Temporomandibular Disorder—Myofascial Pain with Referral. Journal of Clinical Medicine, v. 12, n. 5, mar. 2023.
T, G. et al. Relationship between specific temporomandibular disorders and impaired upper neck performance. European journal of oral sciences, v. 128, n. 4, ago. 2020.
THAMBAR, S. et al. Botulinum toxin in the management of temporomandibular disorders: a systematic review. The British journal of oral & maxillofacial surgery, v. 58, n. 5, p. 508–519, jun. 2020.
VIEIRA, L. S. et al. The Efficacy of Manual Therapy Approaches on Pain, Maximum Mouth Opening and Disability in Temporomandibular Disorders: A Systematic Review of Randomised Controlled Trials. Life, v. 13, n. 2, fev. 2023.
VISSCHER, C. M. et al. The Tampa Scale for Kinesiophobia for Temporomandibular Disorders (TSK-TMD). Pain, v. 150, n. 3, p. 492–500, set. 2010.
WU, J.-Y. et al. Acupuncture therapy in the management of the clinical outcomes for temporomandibular disorders: A PRISMA-compliant meta-analysis. Medicine, v. 96, n. 9, p. e6064–e6064, mar. 2017.
YAO, Y. et al. The association between forward head posture and masticatory muscle pressure pain thresholds in patients with temporomandibular joint dissorders: a cross-sectional observational study. Clinical Oral Investigations, v. 27, n. 1, p. 353–360, jan. 2023.
YIN, Y. et al. The neuro-pathophysiology of temporomandibular disorders-related pain: a systematic review of structural and functional MRI studies. The Journal of Headache and Pain, v. 21, n. 1, 2020.
Mais do E-fisio
Tendinopatias do Tendão Tibial Posterior A disfunção do tendão tibial posterior (DTTP) é uma condição comum entre as patologias do pé e tornozelo. …
Lesões do Ligamento Colateral Medial O ligamento colateral medial situa-se entre o côndilo medial do fêmur até o côndilo medial da tíbia. Sua …
Fratura de escafóide As fraturas de escafóide interferem diretamente na funcionalidade. São pontos chave para uma boa recuperação a abordagem no tempo certo …
Fraturas de Platô Tibial Fraturas do platô tibial podem ser graves e gerar grande perda funcional ao joelho acometido. Por isso necessitam de …
Síndrome do Impacto Femoroacetabular A síndrome do Impacto Femoroacetabular (IFA) costuma ser um importante acometimento da articulação do quadril, resultando em limitações funcionais …
Tendinopatia patelar A Tendinopatia Patelar (TP) costuma ser um importante acometimento da articulação do joelho, frequentemente apresentada como dor anterior na articulação, resulta …
Síndrome da Dor Femoropatelar Síndrome da Dor Femoropatelar é um termo geral usado para descrever a dor retropatelar. É uma condição persistente que …